ELEKTROKIMIA
Beberapa alat elektronik dapat bekerja karena adanya baterai, cara
kerjanya menggunakan prinsip elektrokimia. Salah satu contohnya yaitu aki pada
mobil.
Elektrokimia adalah ilmu yang mempelajari aspek elektronik dan
reaksi kimia. Elemen yang digunakan dalam reaksi elektrokimia
dikarakterisasikan dengan banyaknya elektron yang dimiliki. Dengan kata lain,
elektrokimia adalah ilmu yang mempelajari hubungan antara perubahan (reaksi)
kimia dengan kerja listrik, yang biasa melibatkan sel elektrokimia yang
menerapkan prinsip reaksi redoks dalam aplikasinya.
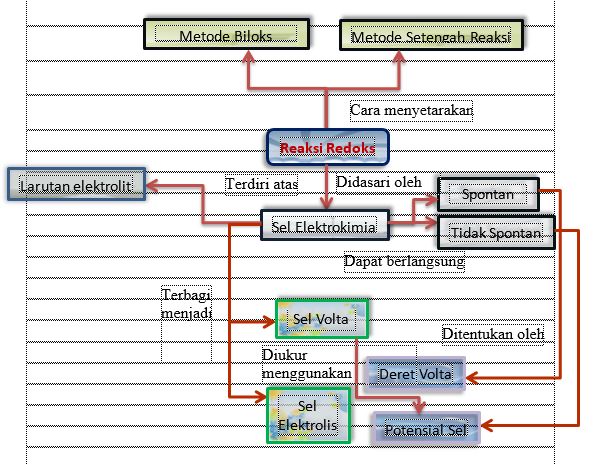
Berikut ini adalah peta konsep dari materi elektrokimia.
Reaksi redoks merupakan gabungan dari reaksi reduksi dan reaksi
oksidasi yang berlangsung secara bersamaan. Peristiwa pelepasan elektron
disebut reaksi oksidasi, sedangkan peristiwa penangkapan elektron disebut
reaksi reduksi. Zat yang mengalami oksidasi dinamakan reduktor karena zat
tersebut menyebabkan zat lain mengalami reduksi. Sedangkan zat yang mengalami
reduksi dinamakan oksidator karena zat tersebut menyebabkan zat lain mengalami
oksidasi.
Kespontanan suatu reaksi dapat ditentukan dengan dua cara, yaitu
dengan menggunakan deret volta atau dengan menghitung potensial selnya.
Urutan logam – logam pada deret
volta :
Logam disebelah
kanan atom H
|
Logam disebelah kiri
atom H
|
Mudah mengalami reduksi
|
Mudah mengalami oksidasi
|
Logam aktif (mudah
melepas elektron)
|
Sangat sulit melepaskan
elektron
|
Semakin ke kanan, sifat
reduktor semakin lemah (sulit teroksidasi)
|
Semakin ke kiri, sifat
reduktor semakin lemah (mudah teroksidasi)
|
Logam deret volta dapat mereduksi unsur si kananya, tapi tidak
mampu mereduksi unsur di kirinya. Jika suatu logam dapat mereduksi unsur
disebelah kanannya, maka reaksi tersebut berlangsung spontan, dan sebaliknya.
Reaksi reduksi dapat menimbulkan potensial listrik tertentu yang
disebut potensial reduksi atau ptensial elektroda dengan simbol E. Nilai E
disebut juga harga Eº yang merupakan potensial reduksi standart atau potensial elektroda
standart.
|
Eº oksidasi = - Eº reduksi
|
Gambar disamping menujukkan pengukuran potensial sel menggunakan
sel elektrokimia.
eaksi sel merupakan penjumlahan dari dua setengah reaksi, yaitu
reaksi oksidasi dan reaksi reduksi. Maka dari itu, elektron yang dilepas dan
yang diterima harus setara.
Misalnya
:
E0sel = E0sel katoda - E0sel anoda
Maka
nilai potensial sel dapat dihitung dengan cara :
Reaksi
redoks dikatakan spontan jika potensial selnya bernilai positif.
Jenis sel
elektrokimia yang dapat menghasilkan energi listrik yaitu sel volta. Pada
gambar disamping, peristiwa oksidasi terjadi pada anode karena elektron dilepas
dari atom – atom Zn dan masuk ke dalam larutan. Sedangkan peristiwa reduksi,
elektron dari Zn mengalir melewati kabel menuju ke elektrode Cu. Cara menuliskan reaksi kimia dalam sel volta yaitu :
Jenis dan kegunaan dari sel volta
1.
Sel volta primer merupakan sel
volta yang tidak dapat diperbarui (sekali pakai).
Misalnya :
·
Sel kering (baterai biasa)
·
Baterai alkaline
·
Baterai merkuri oksida
·
Baterai perak oksida
·
Baterai lithium.
2.  Sel volta sekunder merupakan sel
volta yang dapat diperbarui (dapat digunakan kembali dengan cara dicharge).
Sel volta sekunder merupakan sel
volta yang dapat diperbarui (dapat digunakan kembali dengan cara dicharge).
Misalnya :
·
Akumulator (aki)
·
Baterai Ni-Cd
·
Baterai Ni-Logam hidrida
·
Baterai ion lithium
3.  Sel volta bahan bakar (fuel cell) merupakan sel volta yang tidak dapat diperbarui tetapi juga tidak
habis, elektrodanya berupa gas – gas yang ditambahkan terus – menerus salama
sel itu bekerja.
Sel volta bahan bakar (fuel cell) merupakan sel volta yang tidak dapat diperbarui tetapi juga tidak
habis, elektrodanya berupa gas – gas yang ditambahkan terus – menerus salama
sel itu bekerja.
Misalnya : sel
campuran hidrogen dan oksigen yang digunakan sebagai bahan bakar pesawat luar
angkasa.
Cara Kerja Sel kering dan Baterai Alkaline
Gambar
bagian – bagian sel kering
 Baterai alkaline lebih tahan lama daripada sel kering, cara
kerjanya hampir sama. Hanya saja baterai alkaline menggunakan KOH yang bersifat
basa sebagai pengganti NH4Cl dalam pasta.
Baterai alkaline lebih tahan lama daripada sel kering, cara
kerjanya hampir sama. Hanya saja baterai alkaline menggunakan KOH yang bersifat
basa sebagai pengganti NH4Cl dalam pasta.
Gambar baterai alkaline
Cara Kerja Baterai Oksida
dan Baterai Merkuri Oksida
Zn berfungsi seagai anode, Ag2O sebagai katode.
Sedangkan pasta KOH sebagai elektrolit.
Baterai perak oksida Baterai merkuri oksida
Cara Kerja Baterai Aki (Accu)
Sel akitersusun atas pasangan – pasangan keping Pb sebagai anoda,
dan keping PbO2 (timbal oksida)sebagai katode dngan voltase sebesar
2volt. Keping – keping tersebut disusun secara seri berpasangan biasanya 3
hingga 6 pasang.
Cara Kerja Baterai Ion Lithium
Cara Kerja Sel Bahan Bakar
Oleh : Laila Nihayatul Khusna (15630004)







Leave a Comment